Высушивание
Под высушиванием (осушением) обычно понимают удаление воды или остатков растворителя из жидкого, твердого или газообразного вещества.
Высушивание можно проводить физическими методами, обычно используемыми для разделения и очистки веществ (испарение, вымораживание, экстракция, азеотропная перегонка, дистилляция, сублимация и др.), а также с помощью осушающих реагентов.
При выборе способа осушения следует учитывать агрегатное состояние вещества, его химические свойства, содержание воды или другого вещества, которое надо удалить при сушке, и требуемую степень осушения.
Осушающие вещества
Химические осушающие реагенты можно разделить по способам связывания ими воды на три основные группы.
1. Вещества, образующие с водой гидраты. Это безводные соли (СаСl2, К2СО3) или низшие гидраты, переходящие при контакте с водой в устойчивые высшие гидраты (Mg(ClO4)2-2Н2O).
2. Вещества, поглощающие воду в результате химической реакции, например некоторые металлы (Na, Са) и оксиды (Р4O10, СаО).
3. Вещества, поглощающие воду за счет физической адсорбции, например активный оксид алюминия, силикагель, цеолиты.
Вещества, образующие гидраты
Хлорид кальция СаСl2 наиболее часто используется как наполнитель осушающих трубок и колонок при сушке газов, как поглотительный реагент в эксикаторах и для непосредственного осушения многих органических жидкостей.
Хлорид кальция применяют в порошкообразном или прокаленном виде. Порошкообразный безводный СаСl2 содержит, как правило, небольшое количество основной соли Са(ОН)Сl. Хлорид кальция - осушитель средней эффективности. Мало эффективен для осушения НСl, HBr, HI, Br2, SO3 и совершенно непригоден для осушения аммиака и аминов, с которыми образует комплексные соединения. Хлорид кальция можно, употреблять неоднократно, если его после каждого использования регенерировать прокаливанием.
Концентрированная серная кислота H2SO4 - эффективный реагент для осушения газов, с которыми H2SO4 не реагирует (Н2, O2, N2, Сl2, СН4, С2Н6, СО, НСl, N2O и др.). Запрещается применять серную кислоту в вакуум-эксикаторах в качестве водопоглощающего средства.
Конц. H2SO4 - довольно сильный окислитель, особенно при нагревании. Она окисляет HI и частично HBr (но не НСl) до свободных галогенов. Поэтому ее нельзя использовать для осушения этих веществ, а также H2S, РН3, AsH3, HCN, непредельных углеводородов, аммиака, аминов. Осушающая эффективность H2SO4 резко снижается по мере постепенного разбавления ее водой. Так, 95,1% кислота проявляет уже значительно меньшую эффективность, чем 98,3% кислота. Конц. H2SO4 иногда содержит SO2. Поэтому перед осушением газов нужно нагреть кислоту до появления дыма, при этом SO2 полностью удаляется.
Перхлорат магния (ангидрон) Mg(ClO4)2 - высокоэффективный осушающий реагент, может служить для осушения большинства газов.
Ангидрон применяется для поглощения паров воды в элементном анализе органических веществ при определении содержания водорода, а также для определения абсолютной влажности воздуха. По эффективности высушивания ангидрон не уступает оксиду фосфора (V), выгодно отличаясь от последнего тем, что применяется в виде зерен, не спекается при поглощении паров воды и не образует в колонке каналов.
Перхлорат магния поступает в продажу также и в виде тригидрата Mg(ClO4)2-3H2O, который по осушающему действию сопоставим с конц. H2SO4.
При использовании перхлоратов следует иметь в виду, что сильные минеральные кислоты и кислотные оксиды разлагают их с выделением свободной хлорной кислоты, способной взрываться при взаимодействии с осушаемым газом. Поэтому нельзя последовательно соединять поглотительный сосуд с Mg(СlO4)2 и промыватель с конц. H2SO4.
Карбонат калия безводный (плавленый поташ) К2СО3 применяют для осушения жидкостей и растворов веществ в органических растворителях, когда можно не опасаться щелочности реагента (осушение органических оснований, спиртов и т. д.), В лабораторных условиях осушитель готовят непродолжительным нагреванием товарного карбоната калия на металлической сковороде.
Сульфат натрия безводный Na2SO4 - относительно малоэффективный осушитель. Его применяют для осушения растворов органических веществ в неполярных растворителях (бензол, диэтиловый эфир и др.). Получают прокаливанием Na2SO4-10H2O на металлической сковороде.
Сульфат магния безводный MgSO4 - более эффективный и емкий осушитель, чем безводный Na2SO4. Получают прокаливанием MgSO4-7H2O при 210-250 °С.
Сульфат кальция безводный Ca2SO4 по осушающей эффективности сходен с конц. H2SO4. Применяют для осушения газов и жидкостей, а также для наполнения эксикаторов.
Гидроксиды натрия и калия NaOH и КОН применяют для наполнения поглотительных трубок, колонок (при осушении газов) и эксикаторов, а также для непосредственного осушения некоторых органических жидкостей. Плавленый NaOH для осушения газов столь же эффективен, как и гранулированный СаСl2. Эффективность плавленого КОН во много раз больше эффективности NaOH.
Гидроксиды щелочных металлов часто используются для одновременного поглощения Н2O и СO2.
Вещества, связывающие воду в результате химической реакции
Оксид фосфора (V) P4O10 - исключительно эффективный осушающий реагент, однако очень неудобен в обращении. Под действием паров воды порошок Р4О10 превращается в тягучую клейкую массу, покрытую непроницаемой вязкой пленкой, что создает большое сопротивление току газа. Поэтому Р4О10 обычно наносят на стеклянную или асбестовую вату, стеклянные бусинки или кусочки прокаленной пемзы. Пемзу нагревают в фарфоровой чашке до 100°С и затем смачивают конц. Н3РO4. Затем на пемзе при перемешивании распределяют оксид фосфора. В результате образуются удобные в обращении гранулы реагента.
С галогенами (за исключением фтора) оксид фосфора не реагирует. С сухими HF, НСl и HBr образует оксигалогениды и метафосфорную кислоту:

Оксиды кальция и бария СаО и ВаО рекомендуются исключительно для осушения низших спиртов, в которых образующиеся гидроксиды кальция и бария нерастворимы.
Натрий - весьма эффективный реагент для осушения углеводородов, простых эфиров и др. Поверхность металла быстро покрывается слоем гидроксида, и дальнейшее осушение замедляется. Поэтому стремятся вносить металл с возможно большей удельной поверхностью, например в виде тонкой проволоки. Натрий можно применять для осушения жидкостей, содержащих лишь незначительное количество воды.
Гидрид кальция CaH2 - очень эффективный осушающий реагент. Его реакция с водой протекает необратимо в широком интервале температур.
Гидрид лития-алюминия LiAlH4 - один из наиболее эффективных осушающих реагентов. Его применяют только для полного удаления следов влаги из органических жидкостей.
Вещества, связывающие воду в результате адсорбции
Преимущество сорбентов заключается в том, что они доступны, большей частью химически инертны по отношению к осушающему газу, не создают значительного сопротивления току газа (при использовании их в зерненом виде) и легко регенерируются нагреванием в токе сухого воздуха.
Крупнозернистый активный оксид алюминия (алюмогель) - более эффективный осушающий реагент, чем силикагель.
По осушающей активности цеолиты намного превосходят алюмогель и силикагель. Цеолиты некоторых марок интенсивно поглощают пары воды даже при 100°С, а аммиак при 250-300°С, когда силикагель полностью теряет активность. Так, например, цеолит марки КА адсорбирует при обычной температуре преимущественно молекулы воды. При 70°С 1 см3 таблетированного цеолита КА удерживает 62-85 мг Н2O.
Высушивание твердых веществ
Процесс высушивания твердых веществ большей частью основан на испарении влаги, которое может быть проведено при комнатной температуре или при нагревании. Влага испаряется в том случае, когда давление паров воды над поверхностью твердого осушаемого вещества превышает парциальное давление паров воды в окружающей газовой фазе. Давление паров воды в осушаемом веществе резко возрастает с увеличением температуры. Поэтому высушивание стараются осуществлять при повышенной температуре. Снизить парциальное давление паров воды в газовой фазе можно применением вакуума или осушением с помощью веществ, эффективно поглощающих влагу из газовой фазы.
Многие твердые негигроскопичные вещества можно высушивать на открытом воздухе при обычной температуре. Влага с поверхности вещества будет испаряться до тех пор, пока не установится равновесие между давлением водяных паров в испытуемом веществе и в воздухе. Для ускорения процесса, если это допустимо, высушивание проводят при движении воздуха или перемешивании материала. Толщина слоя высушиваемого материала не должна превышать 1-2 см. В результате высушивания на воздухе получают воздушно-сухой продукт с весьма неравномерным содержанием остаточной влаги. Часто высушивание на воздухе предваряет высушивание другими методами. Высушивание твердых веществ на воздухе лучше всего проводить на фильтрокерамических пластинках; при высушивании на фильтровальной бумаге продукт загрязняется ее волокнами.
Осушаемое на воздухе вещество целесообразно покрывать фильтровальной бумагой, чтобы защитить его от пыли и механических загрязнений. Кроме того, надо учитывать фотохимическое действие освещения на продукт. Так, многие бромиды при высушивании на воздухе желтеют под действием света.
Твердые вещества, устойчивые термически, могут быть высушены в сушильных шкафах. В сушильных шкафах нельзя удалять летучие вещества, например остатки летучих органических растворителей, так как смесь паров растворителя с воздухом может взорваться при контакте с проволочной спиралью нагревателя, и нельзя высушивать низкоплавкие вещества.
При высушивании мелкокристаллических веществ на их поверхности может образоваться плотная корка, значительно снижающая скорость осушения. В этих случаях осушаемое вещество в процессе сушки следует многократно перемешивать. Вещества, легко разлагающиеся или изменяющиеся при нагревании до 100°С, следует сушить в вакуум-сушильных шкафах.
В последнее время в лабораторной практике стали применять сушильные установки, в которых в качестве источника тепла используют инфракрасные лампы. Инфракрасные лучи с длиной волны 1000-3000 нм обладают достаточной проникающей способностью и не вызывают химических изменений в осушаемом веществе. Сушка происходит при более низкой температуре и быстрее, чем при обычном нагревании веществ. Приборы для высушивания материалов инфракрасным облучением выпускаются серийно. Потребляемая мощность лампы 500 Вт. Время высушивания навески в 3 г от 5 до 10 мин. Вначале включают лампу, и в центр освещенного круга помещают резервуар термометра. Регулируя высоту рефлектора, создают требуемую температуру для осушения вещества. После этого в центр освещенного круга помещают сосуд с осушаемым веществом на установленное время.
Высушивание твердых веществ воздухом, осушаемым химическими реагентами, в лабораторных условиях осуществляется в эксикаторах. Осушающий реагент подбирают в зависимости от химических свойств высушиваемого вещества. Чаще всего на дно эксикатора помещают безводный CaCl2, Mg(ClO4)2, Р4О10, плавленый КОН, силикагель, цеолиты. Для удаления остатков углеводородных растворителей в качестве заполнителя для эксикатора применяют парафиновые стружки или полоски фильтровальной бумаги, пропитанные расплавленным парафином.
В эксикаторе водяные пары перемещаются вследствие диффузии или конвекционных токов и поэтому высушивание происходит медленнее, чем в токе воздуха. Для ускорения процесса при комнатной температуре используют вакуум-эксикаторы. Вакуум создается обычно водоструйным насосом. В тех случаях, когда малые количества вещества необходимо осушить в вакууме при повышенной температуре, применяют прибор, называемый «осушительным пистолетом» (рис. 127). В реторту 4 помещают поглотитель влаги (Р4О10, СаСl2, адсорбенты). В колбу 3 наливают до половины объема жидкость с определенной температурой кипения и вносят несколько «кипятильных камешков». В сосуд 1 в фарфоровой лодочке 5 вносят высушиваемое вещество. Кран реторты соединяют с вакуум-насосом. Жидкость в колбе 3 нагревают до кипения. Горячие пары омывают сосуд 1, конденсируются в холодильнике и вновь стекают в колбу 3. Через некоторое время в сосуде 1 устанавливается температура, равная температуре паров применяемой жидкости.

В качестве теплоносителя обычно применяют негорючие жидкости: хлороформ (tкип = 61 °С), трихлорэтилен (tкип = 86 °С), воду (tкип = 100 °С), тетрахлорэтилен (tкип = 120 °С), трихлорэтан (tкип = 146 °С).
Твердое вещество (осадок) можно обезвоживать экстракцией растворителем, который смешивается с водой, но в котором осадок не растворяется или очень плохо растворяется. Например, для быстрого высушивания осадков применяют ацетон, метиловый или этиловый спирт, эфир. Высушивание влажных кристаллических осадков может быть выполнено одним из следующих приемов.
1. Высушиваемое вещество помещают в коническую колбу с пришлифованной стеклянной пробкой, куда прибавляют соответствующий растворитель в таком количестве, чтобы над осадком был слой растворителя в несколько сантиметров. Колбу закрывают и энергично встряхивают около 1 мин, после чего дают отстояться 15-20 мин. Затем осторожно сливают растворитель и заменяют его свежей порцией. Растворитель меняют 3-4 раза, после чего осадок переносят на воронку с пористым дном (воронка Бюхнера), отфильтровывают при разрежении и, если осушаемое вещество негигроскопично, высыпают на керамическую пористую плитку, покрывают листом фильтровальной бумаги и оставляют на воздухе (или под тягой) до полного испарения растворителя. Гигроскопические вещества досушивают в вакуум-эксикаторе или в вакуум-сушильном шкафу.
2. Высушиваемое вещество помещают на воронку с пористым стеклянным дном и понемногу поливают высушивающей жидкостью (растворителем). Затем воронку присоединяют к установке для отсасывания и отфильтровывают растворитель. Отключив установку от источника вакуума, осадок на фильтре разрыхляют стеклянной палочкой или фарфоровым шпателем, вновь приливают растворитель, дают осадку постоять под слоем растворителя 10-15 мин, после чего вновь подключают установку к источнику вакуума. Фильтруют до тех пор, пока не перестанет чувствоваться запах растворителя. Когда это достигнуто, отключают вакуум, а обезвоженный осадок помещают в банку.
Высушивание жидкостей и растворов
Жидкости, содержащие относительно большие количества воды, высушивают в два этапа: сначала физическими методами, а затем доосушивают с помощью химических осушающих реагентов и адсорбентов.
Некоторые органические жидкости, содержащие воду, можно предварительно осушить высаливанием - прибавлением к ним электролита, не растворяющегося в органическом растворителе, но растворяющегося в воде. Происходит разделение жидкости на два слоя. Водный слой может быть отделен, а органический - доосушен и очищен дистилляцией. Вещество, которым проводят высаливание, может быть добавлено в твердом виде или в виде концентрированного водного раствора; например при помощи NaCl можно удалить большую часть воды из водного раствора метилэтилкетона.
Жидкости, не образующие с водой раздельно кипящих (азеотропных) смесей, часто удается осушить фракционной перегонкой на эффективной колонке. Условие успешного проведения осушения - достаточно большая разница температур кипения осушаемой жидкости и воды. Этим методом, например, можно получить почти сухой метиловый спирт, доосушение которого достигается с помощью химических осушающих средств (металлический кальций, амальгама алюминия) и на цеолите КА.
Если осушаемое вещество очень плохо растворяет воду, но образует с ней двойные или тройные азеотропные смеси, то его можно осушить, отогнав небольшую часть его вместе с водой. До тех пор, пока отгоняется бинарная смесь, дистиллят остается мутным.
В сочетании с азеотропной отгонкой осушение можно проводить методом экстракции. К осушаемой жидкости прибавляют такое количество не смешивающегося с водой органического растворителя, чтобы отделился водный слой, после чего остаток воды из раствора органического растворителя удаляют азеотропной перегонкой.
Осушение органических жидкостей чаще всего проводят при их непосредственном контакте с осушающим реагентом. Осушитель, образующий с водой концентрированные растворы (СаСl2, К2СО3, КОН), прибавляют к осушаемому веществу частями, а образующийся раствор осушающего реагента в воде отделяют в делительной воронке. По окончании высушивания жидкость отделяют от твердого осушающего реагента фильтрацией.
В случае водных растворов термически нестойких веществ применяют лиофильную сушку. Принцип проведения лиофильной сушки весьма прост. Водный раствор полностью замораживают в тонком слое и выдерживают в вакууме 1,33-266 Па (0,01-2 мм рт. ст.). При этом давлении вода быстро испаряется (возгоняется) и замороженный раствор постепенно охлаждается. Удаляемые водяные пары улавливают в охлаждаемых ловушках или при помощи адсорбентов. Лиофильная сушка не сопровождается вспениванием, приводит к образованию мелкокристаллического продукта повышенной растворимости, предохраняет продукт от окислительного действия кислорода воздуха и сохраняет биологическую активность осушаемых веществ.
Для осушения органических жидкостей широко используются адсорбенты - алюмогель и цеолиты. Вместе с водой адсорбенты поглощают и многие другие загрязнения. Так, например, цеолит СаА может быть использован для избирательного поглощения полярных веществ (Н2O, H2S и др.) из неполярных жидкостей. Цеолит NaA применяют для глубокой осушки различных фракций нефти и многих продуктов нефтехимического синтеза.
Осушение газов
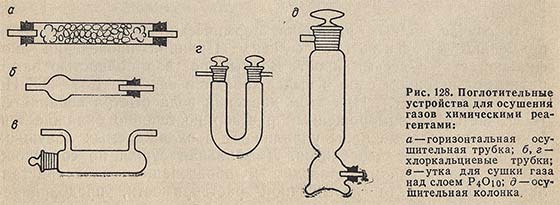
Газы осушают химическими реагентами и вымораживанием. При большой скорости газа равновесие насыщенных водяных паров над осушителем, как правило, не успевает установиться. Степень осушения газа зависит от свойств осушителя, толщины слоя и величины поверхности осушителя, соприкасающейся с газом. Осушение газов твердыми реагентами проводят обычно в поглотительных устройствах (абсорберах), изображенных на рис. 128, и в сосудах для твердых промывателей - склянке Тищенко (рис. 129, а). При наполнении поглотительных устройств необходимо обеспечить равномерное распределение реагента, с тем чтобы в нем не образовались каналы. Для того чтобы укрепить слой осушителя и предотвратить унос его частичек с газом, в поглотительные устройства в местах входа и выхода газа помещают небольшие тампоны стеклянной ваты. После наполнения поглотительных устройств следует убедиться, не создается ли в них слишком сильного сопротивления току осушаемого газа. Если это так, то наполнение повторяют с большими кусками осушающего реагента или же смешивают осушитель с кусками пемзы или пористого фосфора.
Для осушения газов конц. H2SO4 используют сосуды для жидких промывателей (рис. 129). При этом необходимо обеспечить хороший контакт газа с осушающим реагентом и следить за тем, чтобы капельки реагента не уносились током газа. Это достигается подбором высоты осушающего слоя и скорости газа. Сосуды для жидких промывателей можно включать по два последовательно.
Эффективные приборы для промывки газов - поглотительные колонки с орошаемой насадкой из обрезков стеклянных трубок, стеклянных колец или шариков. Преимущество колонок с орошаемой насадкой проявляется в том, что не приходится создавать заметного избыточного давления для прохождения газа.
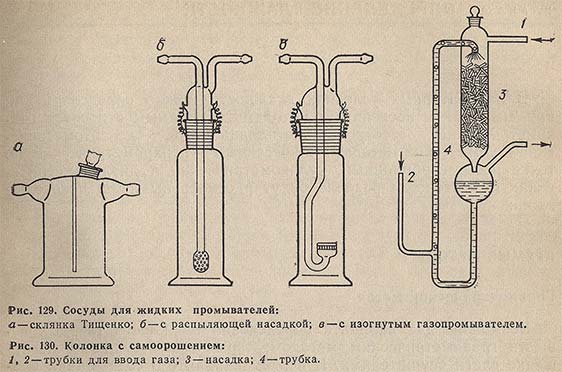
На рис. 130 изображена поглотительная колонка с самоорошением для очистки газа. Газ проходит в трубку 1. Дополнительный поток газа поступает в трубку 2. Увлекая в тройнике капельки жидкости, газ гонит их цепочкой по трубке 4 вверх. Выходя из узкого отверстия над насадкой 3, пузырьки газа лопаются и разбрызгивают жидкость по насадке. Стекающая жидкость отделяется от газа в приемнике и снова возвращается в цикл. Трубку 4, в которой поднимается цепочка пузырьков, делают узкой, так как в противном случае цепочка будет рваться.
Для высушивания газов (паров) наибольшее значение имеют адсорбенты (оксид алюминия, силикагель, цеолиты). Безводный силикагель, содержащий немного хлорида кобальта, окрашен в синий цвет, а при насыщении влагой становится розовым. Таким образом, по внешнему виду сорбента, находящегося в осушительной колонке, можно судить о его пригодности для дальнейшего высушивания.
Высокой степени высушивания газов можно достигнуть вымораживанием, т. е. охлаждением их до низкой температуры. При вымораживании газ пропускают через трубку, погруженную почти до дна сосуда, который помещен в охлаждающую баню.
